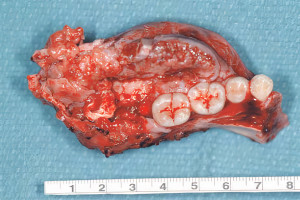
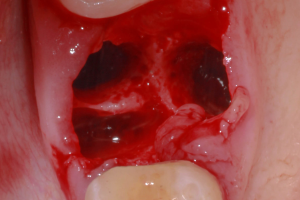
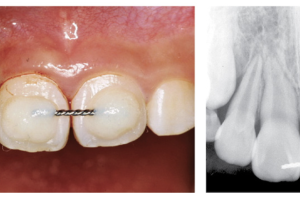
Изучение процесса заживления лунки после удаления зуба стало очень важной темой для исследований и обсуждений в современной стоматологии. Причина этого основывается на том факте, что после удаления зуба в структуре альвеолярного отростка происходят определенные изменения, которые могут создать сложности для имплантации в благоприятной протетической позиции. Учитывая растущие требования к эстетике в стоматологии, необходимо отметить важность сохранения адекватного объема альвеолярного гребня (АГ) для достижения долгосрочного, эстетически приемлемого результата при протезировании с опорой на дентальные имплантаты (ДИ). Поэтому чрезвычайно важно чтобы результат процесса заживления лунки способствовал формированию АГ с достаточным объемом твердых и мягких тканей для получения идеального клинического исхода при протезировании с опорой на ДИ.
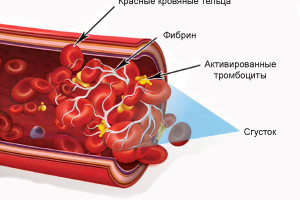
Удаление зуба было однажды описано как ампутация органа, которая может привести к функциональным, физиологическим, постуральным и локальным изменениям. Действительно, удаление зуба изначально воспринимается просто как его потеря, но возрастающие локальные изменения способствуют деформации твердых и мягких тканей АГ. Локальные изменения, которые происходят в процессе закрытия раны и восстановления целостности тканей называются «заживлением лунки». Таким образом, целями данного обзора являются: описание процесса заживления лунки и изучение процесса заживления с точки зрения улучшения клинического исхода лечения.
Альвеолярный отросток
Для понимания процесса заживления лунки и его клинических исходов необходимо знать характеристики тканей, которые составляют его структуру. Ниже представлено краткое анатомическое и гистологическое описание этих тканей.