В данной статье описано изобретение тромбоцитарно обогащенного фибрина — PRF (platelet rich fibrin), как полностью аутогенной системы концентрата крови. Концепт низкоскоростного центрифугирования доказывает, что уменьшение сил центрифугирования насыщает матрицы PRF повышенным числом клеток воспаления и тромбоцитов. Это было показано в сгустках на основе PRF: усовершенствованном тромбоцитарно обогащенном фибрине — A-PRF (Advanced PRF) и усовершенствованном тромбоцитарно обогащенном фибрине плюс — A-PRF+ (Advanced PRF plus). A-PRF+, приготовленный в соответствии с концепцией низкоскоростного центрифугирования, в сравнении с PRF имел повышенное число тромбоцитов и лейкоцитов и показал значительно более высокую концентрацию факторов роста спустя 10 дней. Более того, дальнейшее уменьшении сил центрифугирования, основанное на концепции низкоскоростного центрифугирования, привело к созданию инъекционного тромбоцитарно обогащенного фибрина — i-PRF (injectable PRF), без использования антикоагулянтов. I-PRF, приготовленный с нижайшими скоростями центрифугирования, включает наивысшее число лейкоцитов и тромбоцитов, иллюстрируя эффект концепции низкоскоростного центрифугирования на эту систему концентрата крови. Лейкоциты играют главную роль в заживлении раны и процессе регенерации, их присутствие в сгустках A-PRF и i-PRF показывает повышенную регенерационную способность последних. Эта статья освещает структуру и строение сгустков на основе PRF и их использование в широком диапазоне клинических ситуаций в стоматологии, челюстно-лицевой хирургии и эффективности этого подхода с точки зрения минимальной инвазивности.
В последние десятилетия были представлены различные концепции, клинически применимые для регенерации тканей. В связи с этим, использование чистых биоматериалов в целях направленной костной регенерации и направленной тканевой регенерации является одним из лучших вариантов для минимально-инвазивного подхода в реконструктивной медицине. Более того, для увеличения регенеративной способности биоматериалов, такие концепции как клеточно-тканевая инженерия показали многообещающие результаты в разных преклинических испытаниях. Комбинация биоматериалов с первичными мезенхимальными или эндотелиальными клетками приводит к быстрому приживлению и усиленной васкуляризации при имплантации in vivo на подопытных животных. Однако, разделение и подготовка клеточного материала требует стерильных условий и строгого протокола. Следовательно, использование применение этих методик при хирургических вмешательствах и большие затраты времени являются основными препятствиями для их клинического использования.
Необходимость в новых, менее сложных методиках, привела к внедрению аутогенной системы концентрата крови названной «тромбоцитарно обогащенная плазма» — PRP (platelet rich plasma). В этой системе в собственную кровь пациента добавляются антикоагулянты и бычья сыворотка, затем производится центрифугирование в два этапа. В результате такой методики, полученный концентрат крови состоит из тромбоцитов, тогда как лейкоциты, в норме присутствующие в периферической крови, минимизированы или отсутствуют. Применение тромбоцитарно обогащенной плазмы было широко изучено и показало хорошие результаты в регенерации тканей. Кроме того, плазма обогащенная факторами роста — PRGFs (plasma rich in growth factors) была представлена как концентрат на основе крови, использующий преимущества факторов роста. Так же как и плазма, обогащенная тромбоцитами, этот концентрат крови требует добавок в процессе создания. Однако использование антикоагулянтов и процесс изготовления этих систем всё еще накладывают ограничения для клинического использования. Поэтому остается необходимость в альтернативных, клинически применимых методиках.
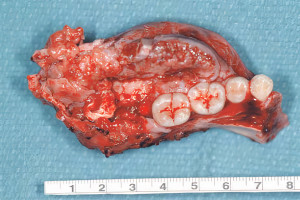
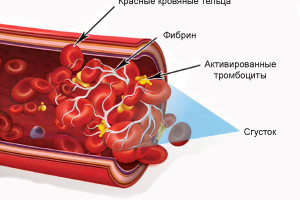
В целях создания более простой и доступной технологии, новая система концентрата крови - тромбоцитарно обогащенный фибрин - PRF (platelet rich fibrin), была представлена как первая полностью аутогенная концепция без добавления антикоагулянтов. В этой концепции была исключена необходимость в антикоагулянтах, что значительно снизило риск загрязнения препарата. Более того, устранение антикоагулянтов позволило сохранить физиологические функции клеток после центрифугирования без ингибирования или стимуляции. Главной задачей было упростить процесс приготовления и минимизировать количество этапов и время, чтобы сделать этот метод более применимым в клинических условиях, так как время — один из самых ценных факторов в клинике. В этой системе периферическая кровь собирается в специальные пробирки и сразу подвергается одноэтапному центрифугированию. Этот процесс активирует коагуляционный каскад и ведет к образованию трехмерного фибринового сгустка. После центрифугирования кровь разделяется на фракцию красных кровяных телец и сгусток PRF, который должен быть аккуратно отделен. Полученный сгусток состоит из верхнего слоя, примыкающего к отделенной эритроцитарной фракции. Тело сгустка состоит из фибриновой сетки, насыщенной тромбоцитами и разнообразными лейкоцитами, которые в норме присутствуют в периферической крови. Более того, было описано медленное и продолжительное выделение факторов роста в сгустках PRF, продолжающееся до 10 дней.