Защита организма и инфекции
Организм человека хорошо подготовлен к борьбе с различными видами инфекционных заболеваний. Неспецифические и специфические иммунные реакции поддерживают здоровый баланс между нормальной микробиотой и организмом хозяина. В случаях, когда первая линия защиты, эпителий, нарушена, защитная система организма человека быстро ограничит проникновение бактерий в ткани и, в конечном итоге, уничтожит бактерии и другие микроорганизмы. Иногда для устранения инфекции применяется системная антибактериальная терапия или такие лечебные манипуляции, как дренирование гнойного очага. Устранение эндодонтической инфекции, однако, происходит другим путем. Принимаемые организмом меры, достаточные для уничтожения инфекционных микроорганизмов в других частях тела, не в состоянии полностью устранить эндодонтическую инфекцию вследствие анатомических особенностей. Устранение эндодонтической инфекции достигается сочетанием нескольких факторов со стороны организма хозяина и лечения. Успех на всех этапах лечения будет необходим для элиминации инфекции и заживления периапикального очага. К таким мероприятиям и процедурам для борьбы с инфекциями в эндодонтии входящим в систему защиты организма, относитсясистемная антибиотикотерапия (применяется редко, только по особым показаниям), инструментальная обработка и ирригация корневых каналов («очистка и формирование»), внутриканальные медикаменты (не всегда используются) между посещениями, постоянное пломбирование корневых каналов и постэндодонтическое восстановление.
Защитная система организма отвечает за предотвращение распространения инфекций корневого канала в кость и другие части тела. Остеокласты резорбируют костную ткань, окружающую апикальное отверстие, а иногда и вокруг наружных отверстий больших инфицированных латеральных каналов. Костная ткань замещается высоко васкуляризованной воспалительной тканью, что имеет большое значение для предотвращения распространения бактерий в кость и возникновения остеомиелита. Эта защита обычно успешна в стабилизации размера поражения и предотвращения его расширения после начального периода роста. Однако, из-за отсутствия кровообращения механизмы защиты организма не могут эффективно достигнуть и атаковать бактерии, обитающие внутри зуба в системе некротизированных корневых каналов. В то время, как инструментальная обработка обеспечивает удаление части бактерий из основного пространства корневого канала, его главная цель заключается в улучшении ирригации и введения медикамента в корневой канал. Ирригация поддерживает инструментальную обработку, уменьшая трение и удаляя, погибшие и живые бактерии из корневого канала. Кроме того, многие ирригационные растворы обладают способностью растворять ткани и/или антимикробной активностью и эффективно очищают пространство корневого канала и убивают бактерии, оставшиеся в канале и смазанном слое дентина. Внутриканальные антимикробные препараты используются при лечении в несколько посещений, чтобы завершить работу, начатую с инструментальной обработки и ирригации, и, в оптимальном случае, очистить систему корневых каналов от бактерий.
Несколько ранних исследований, в которых изучалось присутствие бактерий в корневом канале, показали, что отсутствие бактерий в корневом канале на момент его пломбирования является необходимым условием для высокого процента успеха, и использование гидроксида кальция [Ca(OH)2] в качестве внутриканального лекарственного средства предсказуемо поможет достичь этой цели. Однако, с тех пор ряд других исследований оспорили эти результаты, и в настоящее время нет четкого соглашения относительно использования внутриканальных лекарственных средств для временного пломбирования, а также микробиологических и других преимуществ их использования. Несмотря на такие нерешенные вопросы, нет разногласий в отношении микробиологической цели лечения апикального периодонтита, уничтожения микробиоты в системе корневых каналов.
В этой статье основное внимание уделяется методам ирригации, свойствам и функциям различных ирригантов, а также роли ирригации и внутриканальных медикаментов в уничтожении и уменьшении числа микроорганизмов в системе корневых каналов. Важно, однако, всегда помнить, что ирригация и местное применение внутриканальных антимикробных повязок являются частью согласованных усилий по уничтожению микроорганизмов, вызывающих эндодонтические инфекции. Ирригация и дезинфекция сами по себе не могут гарантировать успешный результат лечения, если есть проблемы с качеством других этапов лечения.
Возможна ли полная элиминация микроорганизмов из системы корневых каналов?
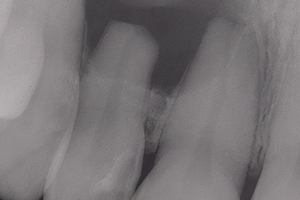
Пульпит вызывается микроорганизмами или их антигенами, попадающими в пульпу из кариозной полости или негерметичную пломбу через дентинные канальцы. Несмотря на воспаление в тканях пульпы, до тех пор, пока пульпа остается витальной, количество бактерий в ней считается минимальным и не имеет клинического значения. Сформировавшиеся биопленки, которые наиболее устойчивы к процедурам при эндодонтическом лечении, как ожидается, не будут обнаружены в пространстве корневого канала при пульпите. Однако, при продолжающейся инфекции, некрозе и апикальном периодонтите микроорганизмы поражают всю систему корневых каналов. Было без сомнения показано, что микроорганизмы являются этиологическим фактором апикального периодонтита (рис. 1). Кроме того, было высказано предположение, что в небольшом числе случаев немикробные факторы ответственны за сохранение поражения после лечения, но также высказывались противоположные мнения.

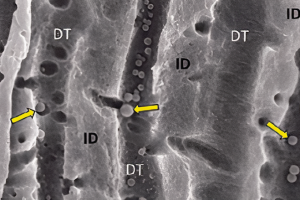
Рисунок 1. Микробная биопленка в корневом канале является причиной апикального периодонтита и, следовательно, основной целью при ирригации и дезинфекции.
Существует общее мнение, что в оптимальной ситуации целью эндодонтического лечения является удаление и уничтожение всех микроорганизмов в корневом канале и нейтрализация любых антигенов, которые могут остаться в канале. Ожидается, что достижение этой цели гарантирует заживление периапикальных поражений. В большинстве случаев за высококачественным лечением следует полное заживление. Однако, полное уничтожение микроорганизмов в корневом канале является особенно сложной задачей. Также было показано, что в большинстве случаев, при которых оставались бактерии на момент пломбирования, наблюдалось полное заживление. Таким образом, ясно, что, хотя оптимальной целью является полное устранение инфекционной флоры, полное клиническое и рентгенологическое заживление также может наступить, когда микробиологическая цель лечения не полностью достигнута. Эту ситуацию можно сравнить с маргинальным пародонтитом и гингивитом, при которых, по понятным причинам, невозможно создать полностью свободную от микроорганизмов среду в области десневой борозды. Очевидно, что качественное лечение заболеваний пародонта приведет к заживлению.
Цель эндодонтического лечения
Конкретная цель эндодонтического лечения зависит от диагноза, поставленного до начала лечения. При апикальном периодонтите, который всегда вызывается микроорганизмами, основной целью является элиминация микробиоты из полости зуба и системы корневых каналов. Поддержание или восстановление структурной целостности зуба является еще одной важной целью лечения. При пульпите корневые каналы свободны от микроорганизмов, поэтому целью является предотвращение микробной инвазии в пространство корневого канала и, следовательно, глубже в ткани.
Другими словами, целью является предотвращение или элиминация микробной инфекции в системе корневых каналов. В некоторых особых ситуациях, таких как резорбции и эндодонтические осложнения, может быть несколько промежуточных целей более технического характера. Даже в этом случае конечный успех зависит от успешного контроля инфекции и/ или сохранения структурной прочности зуба. Широко распространено мнение, что инструментальная обработка и ирригация («очистка и формирование») системы корневых каналов является наиболее важным шагом на пути к очищению канала от микроорганизмов.
Роль инструментальной обработки в антимикробной стратегии в эндодонтии
Целью инструментальной обработки и ирригации является удаление всех некротизированных и не некротизированных органических тканей, а также некоторых твердых тканей их системы корневых каналов. Инструментальная обработка формирует систему корневых каналов для облегчения ирригации, введения внутриканальных медикаментов и постоянного пломбирования корневых каналов. С биологической точки зрения, ключевой задачей инструментальной обработки и ирригации является удаление и уничтожение микроорганизмов, обитающих в некротизированной системе корневых каналов. Кроме того, цель состоит в нейтрализации любого остаточного антигенного материала, остающегося в канале после инструментальной обработки и ирригации.
Классические шведские исследования 1970-х годов сильно повлияли на наше понимание влияния инструментальной обработки и ирригации на внутриканальную микрофлору. В серии исследований на зубах с апикальным периодонтитом авторы продемонстрировали, что при тщательной механической обработке ручными инструментами из нержавеющей стали в сочетании с ирригацией физиологическим раствором, этилендиаминтетрауксусной кислотой (ЭДТА) или ЭДТА и раствором гипохлорита натрия не получилось предсказуемо получить корневые каналы, полностью свободные от бактерий. Пятнадцать корневых каналов были обработаны инструментально в пять последовательных приемов, и были взяты пробы в начале и конце каждого приема. Полость доступа была закрыта временной герметичной пломбой, защищающей от микроорганизмов, но каналы оставались пустыми между посещениями. Эта процедура привела к уменьшению количества бактерий в 100-1000 раз, но было трудно или фактически невозможно получить полностью свободные от бактерий корневые каналы. О соответствующих результатах также сообщили Ørstavik и соавт. и Cvek и соавт. на зубах со сформированными и несформированными верхушками. Сообщалось, что антибактериальный эффект механической обработки со стерильным физиологическим раствором был очень низким и ограничен в зубах с полностью сформированными корнями. Гипохлорит натрия усиливал антибактериальный эффект по сравнению с ирригацией физиологическим раствором. Интересно, что не было обнаружено статистической разницы в антибактериальном эффекте между 0,5% и 5,0% растворами гипохлорита натрия.
Эффекты инструментальной обработки и ирригации были исследованы в серии исследований Dalton и соавт. Авторы измерили снижение количества микроорганизмов у 48 пациентов на зубах, обработанных вращающимися никель-титановыми инструментами (Ni-Ti) с конусностью 0,04 или К-файлами из нержавеющей стали, используя технику step-back с ирригацией физиологическим раствором. Бактериологические образцы были получены до, в процессе и после инструментальной обработки. У всех зубов с апикальным периодонтитом вначале наблюдался положительный рост, тогда как контрольные зубы с витальной пульпой и необратимым пульпитом были стерильными. Снижение количества бактерий было обнаружено при прогрессирующем расширении корневых каналов при обеих методиках. Однако только 28% зубов после инструментальной обработки полностью были очищены от бактерий. Важно иметь в виду, что результаты микробиологических исследований корневых каналов точны настолько, насколько чувствительны методы обнаружения микроорганизмов. Культуральные методы, использовавшиеся в еще более ранних исследованиях, не позволяют получить рост (и обнаружение) привередливых анаэробных бактерий. Более того, получение проб было проведено бумажными штифтами или файлами в тех же областях, где воздействие инструмента было наиболее эффективным. Можно предположить, что механическое удаление микроорганизмов было более эффективным в этих областях, чем в более удаленных, нетронутых частях системы корневых каналов. Таким образом, использование ультразвука для облегчения выделения бактерий из таких локализаций может дать более достоверную картину остаточной микробиоты. Даже молекулярные техники зависят от эффективного взятия проб и минимального количества клеток, позволяющих проводить обнаружение с помощью ПЦР и проб. Однако нет исследований, сравнивающих влияние ультразвука на взятие микробиологических проб из корневого канала.
Наблюдения, аналогичные исследованиям Dalton и соавт., были сообщены Siqueira и соавт., когда при ирригации использовался физиологический раствор. Интересно, что это предыдущее исследование показало, что увеличение размера апикального препарирования с 30 до 40 привело к значительному снижению количества микроорганизмов. Исследования ex vivo, проведенные Pataky и соавт. с использование 40 первых премоляров верхней челюсти человека, удаленных по ортодонтическим показаниям, также подтвердили трудность достижения стерильности инфицированного пространства канала путем инструментальной обработки и ирригации физиологическим раствором. Хотя после инструментальной обработки было обнаружено значительное снижение количества бактерий, ни один из зубов не был полностью свободным от бактерий. Следует отметить, однако, что размер мастер-файла был довольно маленьким, №25, что может увеличить вероятность получения положительных культур. Можно сделать вывод, что инструментальная обработка и ирригация физиологическим раствором или непосредственно антимикробными средствами, такими как гипохлорит натрия, не могут предсказуемо устранить всех микроорганизмы из инфицированных корневых каналов. Поэтому неудивительно, что основное внимание в области дезинфекции корневых каналов уделяется разработке и использованию методов ирригации, растворов, а также других внутриканальных дезинфицирующих средств с высокой очищающей эффективностью и антибактерильной активностью. В последние годы наблюдается значительная активность в разработке новых методов ирригации, которые добавили бы эффективные механические или «энергетические» компоненты к гидродинамической, химической ирригации.
Исследования в области ирригации и дезинфекции в эндодонтии: методы, модели и проблемы
Наше понимание и восприятие различных ирригантов для корневых каналов, методов ирригации и их воздействия частично основано на клиническом опыте, но также, и даже в большей степени, на исследованиях in vitro, ex vivo и in vivo, касающихся эффектов, рисков и преимуществ ирригации. Изучение ирригации, возможно, на удивление, непросто. Одной из самых больших проблем является особенная микроанатомия зубов и системы корневых каналов. Также, сложность реального моделирования событий invivo в условиях in vitro усугубляет проблему. Ниже критически обсуждаются различные исследовательские стратегии и модели в области ирригации.
Модели in vitro для тестирования антимикробной активности
Тестирование антимикробной активности различных химических соединений, используемых в эндодонтии, может показаться простой процедурой. Теоретически это может быть правдой, когда интересующие микроорганизмы подвергаются воздействию исследуемого антимикробного средства. Через определенные промежутки времени отбираются микробиологические образцы и культивируются на подходящих средах. Затем результаты выражаются в виде продолжительности времени, необходимого для уничтожения всех микроорганизмов. Однако реальность с эндодонтическими дезинфицирующими средствами совершенно иная. В исследованиях, посвященных антимикробной эффективности ирригационных растворов и внутриканальных лекарственных средствах для временного пломбирования, во многих случаях использовались методы, первоначально разработанные для каких-либо других условий; например, тестирование чувствительности бактерий к системным антибиотикам с использованием агаровых пластин. Исследование системных антибиотиков основано на десятках лет международной стандартизации. Химические состав как дисков с антибиотиками, так и питательных сред, используемых при тестировании, детально определен, чтобы обеспечить предсказуемую диффузию активного ингредиента антибиотика и отсутствие химических реакций между ингредиентами агаровой среды и антибиотика, о котором идет речь. Зоны ингибирования роста вокруг диска с антибиотиком были сопоставлены в ходе клинических исследований с концентрациями в сыворотке крови и тканях, которые могут быть достигнуты при использовании безопасных доз с низкой токсичностью, а также при оценке клинической эффективности антибиотиков. Кроме того, эталонные штаммы из коллекций культур с известной чувствительностью к антибиотикам используются в качестве внутренних стандартов для тестирования качества каждой новой партии пластин. Большинство аэробных и факультативных бактерий могут быть надежно протестированы с помощью диско-диффузного метода. Однако, несмотря на годы обширных исследований, до сих пор не существует общепринятого стандарта тестирования анаэробных бактерий на чувствительность с использованием диско-диффузного метода. Е-тест-полоски, пропитанные антибиотиками, используются для проверки роста анаэробных бактерий на специальных пластинах. Они обладают преимуществами, по сравнению с обычным диффузионным методом в агаре с анаэробными бактериями, и использовались также в эндодонтических исследованиях. Е-тест-полоски не являются соответствующими тест-полосками для эндодонтических дезинфицирующих средств или растворов.
Использование метода диффузии в агар в эндодонтии, несмотря на благие намерения, не основано на стандартизации среды или тестируемых материалов. Химические взаимодействия между средой и дезинфицирующими средствами в значительной степени неизвестны. Более того, нет достоверных сравнительных исследований, позволяющих сделать выводы о размере зон ингибирования и ожидаемой эффективности дезинфицирующих средств in vivo в отношении бактерий корневых каналов. Антимикробный эффект некоторых эндодонтических препаратов основан на влиянии pH. Буферная способность агаровой пластины является ключевым фактором для определения диаметра зоны ингибирования роста. Другим примером является ЭДТА, который вызывает зону ингибирования на чашке с агаром, но не уменьшает количество жизнеспособных микроорганизмов даже после 24-часовой инкубации в пробирке. Wang и соавт. в исследовании об антибактериальном действии ирриганта на дентин сообщили, что ЭДТА вызывала ложноположительную реакцию также при использовании красителя для дифференцированного окрашивания живых клеток и конфокального микроскопа.
Другим важным моментом при тестировании антимикробной эффективности различных соединений, жидкостей или твердых веществ является понимание разницы между бактериостатической и бактерицидной активностью. Бактериостатическое действие означает предотвращение роста микробных клеток без их уничтожения. Бактерицидная активность, с другой стороны, убивает пораженные бактерии. В исследованиях в эндодонтии это различие не всегда четко учитывается, и результаты часто описываются как «антибактериальная активность». Метод диффузии в агар, при правильном использовании на системные антибиотики, является примером измерения бактериостатической активности. В эндодонтии бактерицидный эффект дезинфицирующего средства более важен, чем бактериостатический эффект. В корневом канале с некротизированной пульпой происходит временное предотвращение роста бактерий (бактериостатическое) до тех пор, пока дезинфицирующее средство остается в канале, что имеет ограниченную ценность, поскольку впоследствии бактерии все еще могут увеличиваться в количестве и вызвать новую проблему.
Тестирование дезинфицирующих агентов в эндодонтии in vitro можно проводить в пробирках с использованием смеси бактерий (суспендированных в стерильной воде) и медикамента. В литературе по эндодонтии часто сообщается о присутствии питательной среды в смеси бактерий и медикамента. Это может создать проблему, поскольку питательная среда или другой органический материал являются мешающим фактором, который может инактивировать дезинфицирующее средство или защитить бактерии каким-либо механизмом. Эксперименты, проводимые в таких условиях, могут не дать достоверной картины характеристик и активности медикамента/дезинфицирующего средства против тестируемого микроорганизма.
«Эффект переноса» означает, что лекарственное средство (например, хлоргексидин) переносится вместе с образцом и бактериями в серию разведений и далее в культуру (пластина или жидкую культуру). На питательной среде даже более низкая концентрация «переносимого» лекарственного средства может оказывать бактерицидное или бактериостатическое действие и предотвращать рост микроорганизмов. Достаточно высокая концентрация дезинфицирующего средства, переносимого в питательную среду, может препятствовать росту микроорганизмов и, таким образом, вызывать ложноотрицательный результат. Так, перенос, если он не обнаружен, способствует чрезмерно положительной картине антибактериальной эффективности лекарственного средства. Ирриганты в эндодонтии и дезинфицирующие средства, содержащие местные антибиотики, подвержены особенно высокому риску получения ложноотрицательных результатов. Для многих антибиотиков отсутствуют эффективные инактиваторы.
Для предотвращений последствий переноса используются специальные инактивирующие агенты. Лимонная кислота была использована в корневом канале для нейтрализации гидроксида кальция, тиосульфат натрия нейтрализует гипохлорит натрия, а смесь Твина-80 и альфа-лецитина инактивируют хлоргексидин. Однако инактивация зависит от концентрации лекарственных средств. Когда лекарственные средства используются в высокой начальной концентрации, их и инактивация может быть неполной. Примером этого является хлоргексидин, который невозможно эффективно инактивировать с помощью Твина и альфа-лецитина, если используется хлоргексидин в концентрации 1% или выше (рис. 2). Важность тщательного планирования экспериментов и надлежащего контроля во избежание возможности ложноотрицательных результатов трудно переоценить (рис. 3).
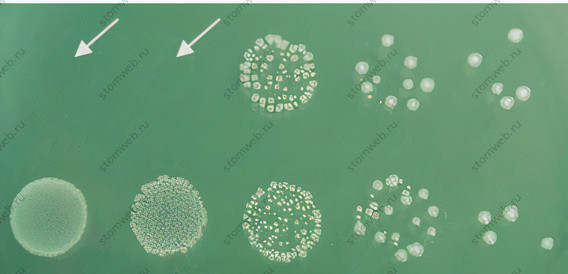
Рисунок 2. Образцы Enterococcus faecalis из серии 10-кратных разведений после кратковременного контакта с 2% хлоргексидином. Из-за короткого времени контакта (две секунды) уничтожение не произошло. Однако «перенос» хлоргексидина предотвратил рост первых двух образцов (стрелки) на планшете (верхний ряд слева), несмотря на присутствие инактиватора Твин-лецитина в серии разведений. Нижний ряд: контрольный образец без хлоргексидина. Если только первые два разведения были бы сделаны после двухсекундного воздействия хлоргексидина, результат свидетельствовал бы о полном уничтожении бактерий всего за две секунды.
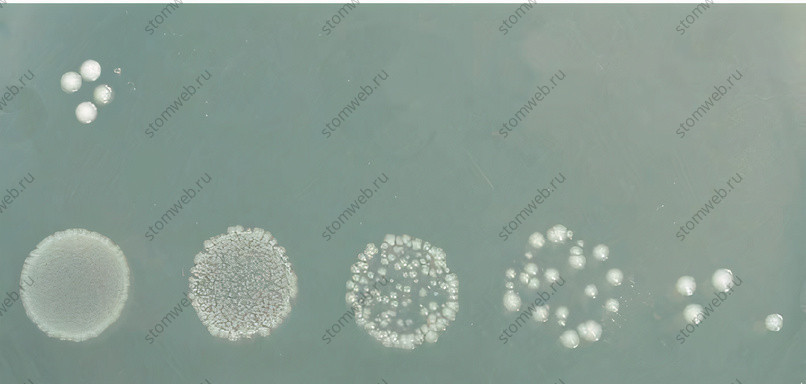
Рисунок 3. Размер исходного посевного материала и глубина серии 10-кратных разведений определяют точность измерения колониеобразующих единиц. В этом примере эффективность уничтожения может быть рассчитана на уровне около 99,99%. Верхний ряд: лекарственное средство уничтожило так много бактерий, что только в неразбавленном образце (крайнем слева) можно увидеть несколько клеток. Нижний ряд: контрольный образец (вода: не уничтожает).
Модели ex vivo и in vivo
Модели in vitro могут дать ценную информацию об антимикробном потенциале эндодонтических дезинфицирующих средств. Однако информации, полученной в экспериментах in vitro, недостаточно для прогнозирования их эффективности в клинической ситуации в корневом канале. Несмотря на хорошие результаты in vitro, эффективность лекарственного средства in vivo может быть ослаблена различными местными факторами в корневом канале. К ним относятся проблемы с доставкой дезинфицирующего средства ко всем частям канала, малый общий объем, плохое проникновение в дентин, короткое время контакта или инактивация активности дезинфицирующего средства различными химическими соединениями, присутствующими в корневом канале с некротизированной пульпой. Ранее был разработан ряд моделей exvivo и in vivo для решения проблемы, связанной с различными сопутствующими факторами корневого канала, и для улучшения корреляции между результатами исследования и клиническими показателями. Модели ex vivoи in vivo включают модель блока дентина, модель порошка дентина и несколько модификаций с использованием корней/ корневых каналов удаленных зубов. Недавно была разработана модель канала дентина с массовым присутствием бактерий в дентинных канальцах, которая использовалась для тестирования эндодонтических материалов на их антимикробную активность с использованием конфокальной микроскопии и красителя для дифференцированного окрашивания жизнеспособных клеток. В конечном счете, необходимы клинические исследования и исследования in vivo.
Модель порошка дентина с его модификациями позволяет получить информацию об ингибировании активности лекарственного средства дентином и другими соединениями (биомолекулами, микробной биомассой и т.д.) в различных концентрациях. Это также позволяет стандартизировать определенные экспериментальные условия для проведения больших серий тестов. Длительное время инкубации для создания инфицирования дентина не требуется, поскольку дентин измельчен в порошок. К недостаткам порошковой модели относятся частичная потеря микроанатомической структуры зуба и сложность создания и использования биопленок.
Модель дентинного блока широко используется для тестирования эндодонтических лекарственных средств. Преимущества модели включают моделирование химической и микроанатомической среды зуба и системы корневых каналов. Корневой канал может быть стандартизирован по размеру, что облегчает получения сопоставимых образцов дентина в разных блоках. Это также позволяет использовать бактериальные биопленки в экспериментах. С другой стороны, модель блока дентина довольно трудоемка в использовании; она не может быть полностью стандартизирована, поскольку различные блоки могут различаться по толщине и микроструктуре дентина. Манипуляции с блоком сопряжены с некоторыми трудностями, которые могут увеличить риск получения ложноположительных результатов (контаминация за пределами зоны взятия проб). Основным ограничением модели дентинного блока с культивированием является ограниченное количество бактерий, проникающих в дентин корневых каналов, а также неточности при взятии проб и культивировании. Несмотря на свои ограничения, модель дентинного блока внесла свой вклад в наше понимание строения дентина.