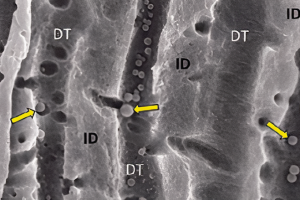
При апикальном периодонтите система корневых каналов колонизирована микроорганизмами. В настоящее время полностью элиминировать эти микроорганизмы только с помощью механической инструментальной обработки невозможно. Следовательно, для уничтожения внутрикорневой инфекции требуются ирриганты. В этой статье обсуждаются различные действия и взаимодействия наиболее часто используемых ирригантов и предлагается клинический протокол ирригации. Для достижения более эффективного результата уничтожения внутрикорневой инфекции должны применяться по крайней мере два разных ирриганта.
Введение
С недавних времен наблюдается прогресс в усовершенствовании характеристик эндодонтических инструментов. С появлением никель-титанового сплава в эндодонтии практически каждый месяц на стоматологический рынок поставляются новые роторные никель-титановые инструменты. Кроме того, существуют несколько новых продуктов и материалов для пломбирования корневых каналов. К сожаленью, все эти новшества фокусируются на технических аспектах лечения. Меньшее внимание уделяют биологическим аспектам терапии. Возобновился интерес во взаимодействии между механической инструментальной обработкой и внутрикорневой дезинфекцией. Инфекционный контроль во время лечения корневых каналов является важным моментом для достижения успешных результатов при проведении консервативного лечения.
Таким образом, целью настоящего исследования является анализ соответствующей литературы о ирригации корневых каналов. Также для ежедневной клинической практики был предложен протокол ирригации и другие важные рекомендации.