Барьерные мембраны играют выдающуюся роль в регенеративной стоматологии с середины 1980 -х, препятствуя прорастанию быстрорастущих мягких тканей в медленнорастущую костную ткань и минерализованные твердые ткани. Сначала они использовались в области зубов и данные методики носили название направленной тканевой регенерации (НТР), но вскоре после этого они стали применяться и для кости в качестве "направленной костной регенерации" (НКР). С годами было достигнуто значительное развитие в области исследования остеокондукции и биосовместимости костных материалов и барьерных мембран. Поскольку оригинальные PTFE нерезорбируемые мембраны, использовавшиеся при первых операциях направленной регенерации, требовали проведения второй операции для их удаления, тем самым увеличивая общую травматичность вмешательств, последнее время изобретались мембраны нового поколения, такие как резорбируемые коллагеновые мембраны, резорбируемые полимеры, а также богатый тромбоцитами фибрин (PRF)
Направленная тканевая регенерация (НТР) и направленная костная регенерация (НКР) были основными методиками, которые использовали стоматологи-хирурги, пародонтологи и стоматологи общей практики для успешного и предсказуемого восстановления тканей пародонта и костной ткани. Что интересно, в середине 1980-х была проведена серия исследований на основе гипотезы о том, что для оптимального процесса регенерации тканей пародонта и альвеолярной кости необходимо исключить из процесса быстрорастущие мягкие ткани. С тех пор изобилие исследований как в области направленной тканевой регенерации, так и в области костной регенерации приобретали большую популярность с различными методиками и биоматериалами, применяемыми для облегчения этой задачи.
Еще одно популярное течение в последние годы связано с развитием богатого тромбоцитами фибрином (PRF), который был представлен в 2001г. С тех пор, его использование быстро росло, что было связано с тем, что он служил 100% натуральным аутогенным источником факторов роста при относительно низкой стоимости. PRFзначительно отличается от предшествующих составов тромбоцитов, включая богатую тромбоцитами плазму (PRP) и факторы роста богатые тромбоцитами (PRGF), тем, что не содержит антикоагулянтов, образуя тем самым фибриновый сгусток в процессе центрифугирования. То есть, PRF это не жидкость, а сгусток, содержащий многочисленные аутогенные факторы роста. PRF также может быть измельчен на части и смешан с различными костными биоматериалами, или его можно отжать до плоского состояния и использовать в качестве барьерной мембраны при процедурах направленной костной или тканевой регенерации. В сравнении с традиционными коллагеновыми мембранами, PRF предлагает многочисленные преимущества, связанные с содержанием как аутогенных факторов роста, так и лейкоцитов в качестве факторов иммунитета. Эти клетки противодействуют различным проникающим патогенам, уменьшая тем самым уровень инфицирования до 10 раз. По этой причине, PRF мембраны имеют преимущество, заключающееся в том, что их можно оставлять открытыми в полости рта без особого страха, благодаря обильному содержанию в них иммунных клеток, способных противостоять патогенам из полости рта. Однако, в то время как влияние PRF на ангиогенез хорошо изучено, статьи о влиянии на регенерацию кости встречаются редко. Большинство литературных источников сфокусировано исключительно на влиянии PRF на заживление ран мягких тканей, очень скудно освещая тему влияния на регенерацию кости. Эта статья преследует цель представить обзор на процедуры направленной костной регенерации и наиболее часто использующиеся биоматериалы, а после этого осветить применение PRF при процедурах направленной костной регенерации в качестве дополнения к костному графту или в качестве барьерной мембарны.
Обзор направленной костной регенерации
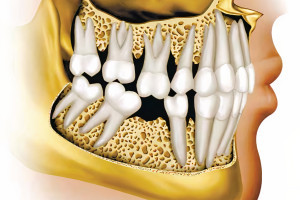
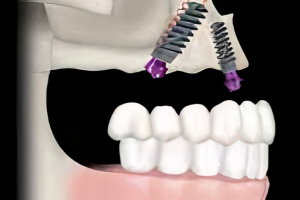
Чтобы достичь стабильных результатов в области зубов и имплантатов, необходимо достаточное количество кости альвеолярного гребня в вертикальном и горизонтальном направлении. Интересно, что концепция направленной костной регенерации и использование барьерных мембран были представлены в области пародонтологии и дентальной имплантологии около 30 лет назад. Эти концепции были основаны на том факте, что мягкие ткани альвеолярных отростков, в сравнении с подлежащими твердыми тканями, имели разную скорость роста и миграции клеток. Барьерная мембрана первоначально пыталась мешать прорастанию быстрорастущих эпителиальных клеток в костные дефекты, чтобы позволить медленно растущей костной ткани восстановить дефект (Рис. 1 и 2). С годами, разнообразие дополнительных параметров, таких как поддержание формы, способность удерживать кровяной сгусток, механическая стабильность, потенциал клеточной инфильтрации, биосовместимость и резорбционные свойства были изучены для достижения более лучшего восстановления кости.
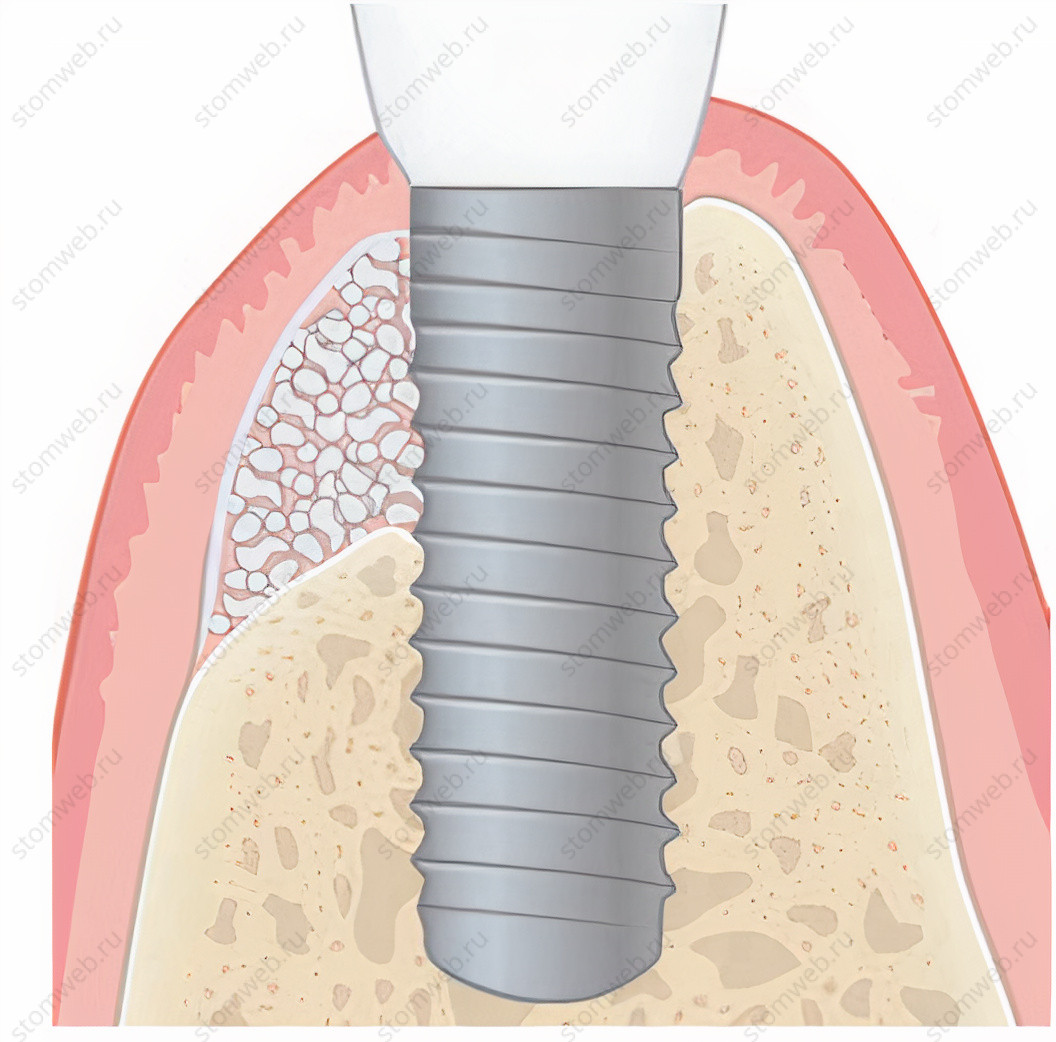
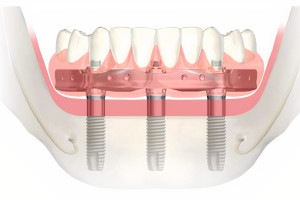
Рисунок 1 Иллюстрация стандартной процедуры направленной костной регенерации в области дентального имплантата. Сначала костным графтом заполняется костный дефект, а затем используется барьерная мембрана для предотвращения прорастания мягких тканей. Регенерация имеет место быть благодаря свойству мембраны удерживать пространство.
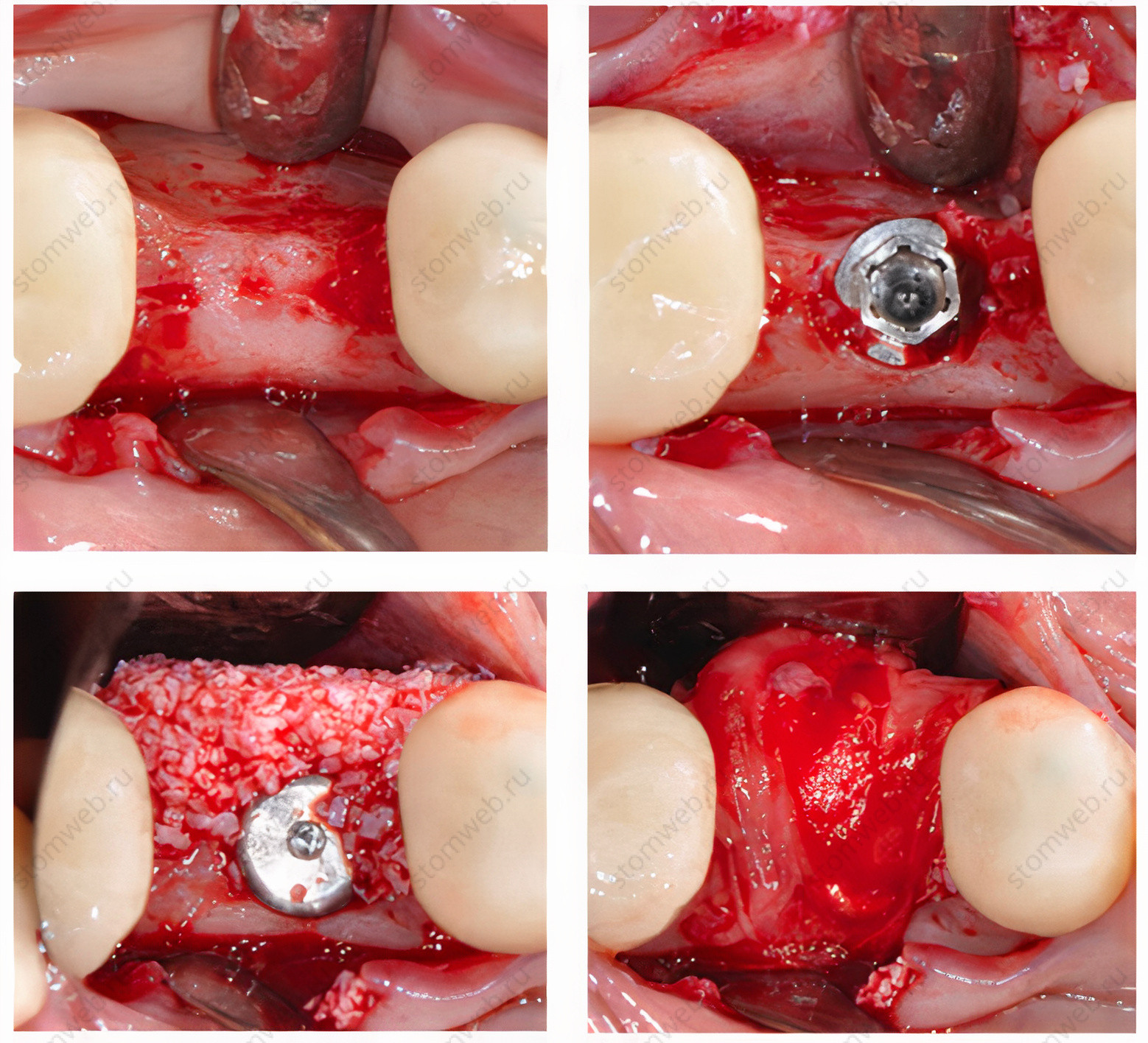
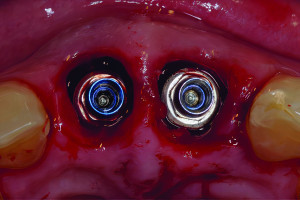
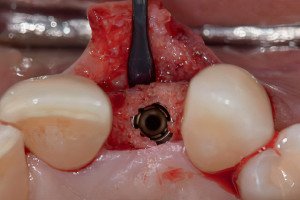
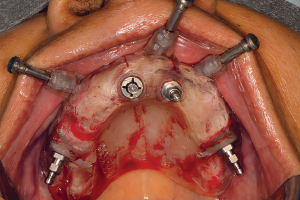
Рисунок 2 Клинический случай процедуры направленной костной регенерации при горизонтальном дефекте альвеолярного отростка вокруг имплантата. После установки имплантата, костный графт пакуется с вестибулярной стороны и перекрывается барьерной мембраной для предотвращения инфильтрации мягких тканей.
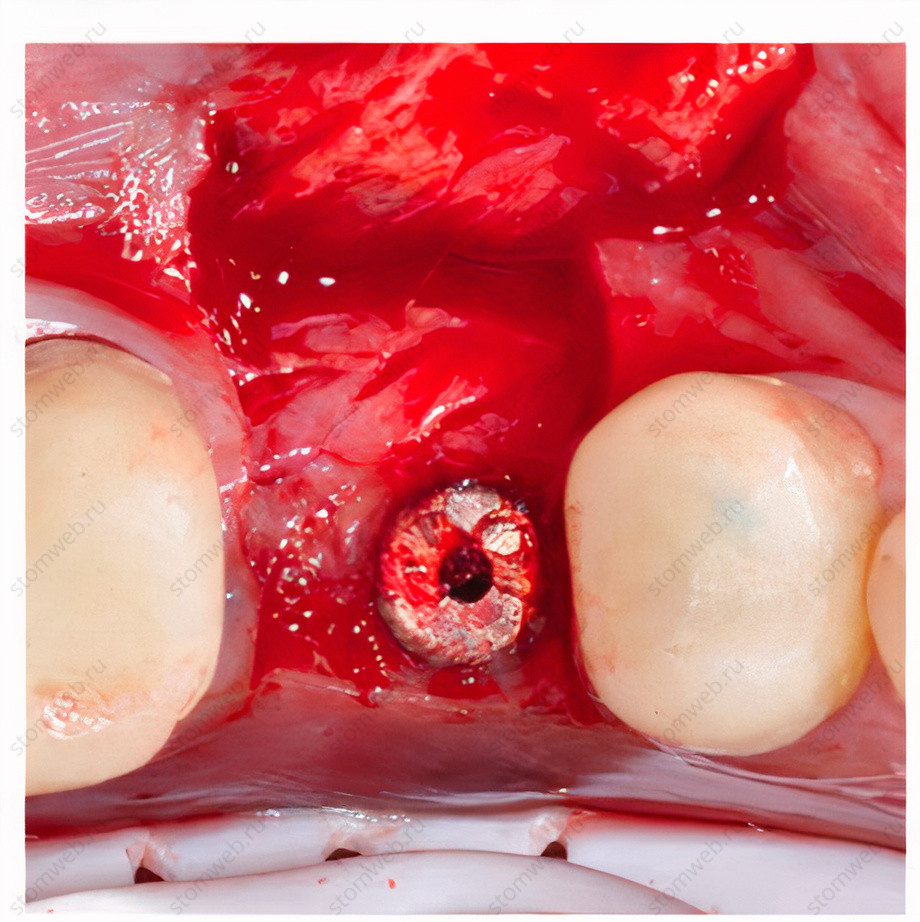
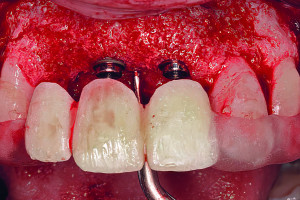
Рисунок 2 Изображение ниже демонстрирует формирование новой кости при раскрытии имплантата через 5 месяцев.
Хотя первые синтетические мембраны из политетрафторэтилена (PTFE) показывали хорошие результаты, в последующем обсуждалась необходимость проведения второй операции для удаления этих мембран, что предполагало дополнительную хирургическую травму, чего можно было бы избежать, используя биоразлагаемые материалы. По этим причинам, резорбируемые коллагеновые и синтетические мембраны стали доступны, практически полностью заместив оригинальные PTFE мембраны.
В общем и целом, направленная костная регенерация продемонстрировала высоко предсказуемые результаты с устоявшимися и хорошо задокументированными протоколами, ведущими к высокому уровню выживаемости имплантатов в пределах от 91,9% до 92,6% в течение среднего периода наблюдения в 12,5 лет в текущих проспективных долгосрочных исследованиях. Различные клинические исследования и исследования на животных продемонстрировали успешность применения направленной тканевой регенерации пародонтальных дефектов, включая внутрикостные, фуркационные и супра-альвеолярные дефекты. Тем не менее, при использовании стандартных техник направленной костной регенерации обязательным условием является заживление раны первичным натяжением, для предотвращения прорастания мягких тканей, бактериальной контаминации, ранней резорбции мембраны или расхождения краев раны и экспозиции графта.
На сегодняшний день в продаже доступны сотни мембран для направленной костной регенерации. Более того, производство костного графта превратилось в индустрию с многомилионной доходностью в год с экспоненциальным ростом доступных для покупки продуктов, которые выводятся на рынок ежегодно. Ниже мы резюмировали доступные биоматериалы и позже мы представим PRF как дешевую, легко производимую мембрану, получаемую из 100% аутогенных источников и ее использование как в комбинации с костными материалами, так и в качестве барьерной мембраны.