В 1892 Julius Wolff установил, что кость является динамической системой, которая адаптируется к физическим требованиям, которые задаются внешней средой (Wolff 1986). На настоящий момент кость считается динамической, васкуляризированной, «живой» тканью, которая может изменяться с течением жизни и является одной из так называемых соединительных тканей тела, и таким образом включает в себя клетки, которые становятся «замурованными» в их собственном внеклеточном матриксе (Davies 2003).
Ответная реакция костной ткани на установку дентальных имплантатов
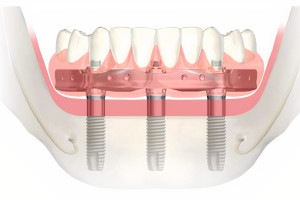
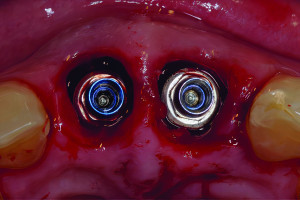
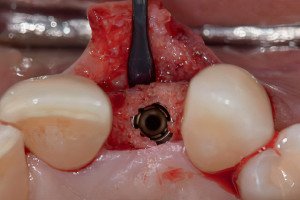
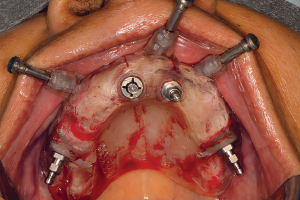
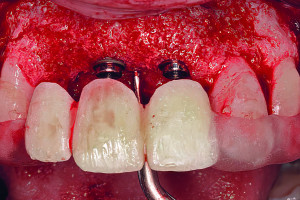
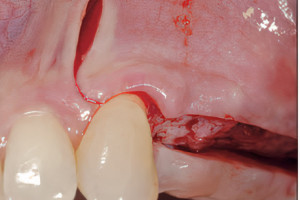
Дентальные имплантаты могут быть интегрированы как на уровне костной, так и мягких тканей. Термин «остеоинтеграция» рассматривает продолжительное функциональное соединение между титановой поверхностью имплантата и костной тканью в области ложа имплантата, данный процесс развивается в течение недель заживления в присутствии или в отсутствии функциональной нагрузки. Непосредственный контакт между костной тканью и имплантатом (т. е. остеоинтеграция) впервые был описан шведским ученым Per-Ingvar Brånemark с коллегами (Adell с колл. 1970; Southam и Selwyn 1970) и впервые гистологически доказан швейцарским ученым Andre Schroeder с коллегами и назван «функциональным анкилозом» (Schroeder с колл. 1976, 1978, 1981); его группа первая зафиксировала непосредственный контакт кость-имплантат у титановых имплантатов в некальцинированных гистологических срезах.
Эти тесные взаимоотношения костной ткани и поверхности имплантата могут возникать отчасти из-за взаимодействия между оксидом титана и костью посредством протеогликанов (Listgarten и колл. 1992). В последующие годы в результате дальнейшего развития исследований на животных выяснилось, что остеоинтеграции подвержены различные материалы и конфигурации поверхностей имплантата (Schenk и Buser 1998; Salvi и Lang 2001). После многих лет изучения были предприняты шаги, чтобы отобразить значительные открытия, такие как то, что шероховатые имплантаты обеспечивают значительно больший контакт между костью и поверхностью имплантата и большую биомеханическую стабильность (Berglundh с колл. 2003; Abrahamsson с колл. 2004; Shalabi с колл. 2006; Le Guéhennec с колл. 2007). Таким образом, с целью улучшения понимания процессов, происходящих во время заживления костной ткани после установки имплантатов, данная статья состоит из различных обзоров наиболее релевантных литературных источников, чтобы раскрыть обоснования основ биологии костной ткани и ключевые моменты последовательного заживления костной ткани после установки титановых имплантатов.
Базовые аспекты биологии и архитектоники костной ткани
Костная система развивается из мезенхимального зародышевого листка и нервного гребня. Формирование костной ткани может происходить двумя путями. У большей части костей, в том числе осевых костей туловища (позвоночный столб и ребра) и костей конечностей, сначала формируется модель хрящевой ткани, которая затем замещается костной, такой тип окостенения называется энхондральным. Наоборот, большая часть плоских костей, такие как почти все кости черепа, формируются непосредственно из мезенхимальных клеток первой жаберной дуги без первичного образования хряща; данный тип остеогенеза называется эндосмальным окостенением (Maruyama 2011).
Кость является специализированной соединительной тканью, обеспечивающей поддержку и механическую стабильность скелета. Данная ткань обеспечивает возможность нагрузки и передвижения, последнее достигается за счет системы рычагов, преумножающих силы от сокращения мышц и преобразующих эти силы в движения тела (например, экскурсии нижней челюсти и окклюзионные силы). Кость скрывает в себе полости, содержащие костный мозг, в котором происходит формирование клеток крови, являющихся важным источником биогенных веществ (например, факторов роста, протеинов и остеогенных клеток-предшественников). Также кость является резервуаром кальция, фосфатов и других ионов, которые могут подконтрольно высвобождаться или аккумулироваться для обеспечения гомеостаза. Разнообразие функций костной ткани связано с ее сложным устройством; кость состоит из кальцинированного экстрацеллюлярного вещества, называемого «костным матриксом», и трех основных видов клеток (остеоциты, остеобласты и остеокласты), у каждой из которых имеются специализированные функции для поддержания здоровья костной ткани.
Минерализованная часть костной ткани насыщена органическими волокнами (волокна коллагена 1 типа встроены в основное вещество, состоящее из протеогликанов, гликопротеинов и неорганических минералов), и считается, что как минералы, так и коллагеновые волокна влияют на механическую прочность тканей (Currey 1969a). Коллагеновые волокна формируют пучки, устойчивые к натяжению, в то время как минеральные вещества обеспечивают жесткость, чтобы противостоять усилиям на изгиб и компрессии (Currey 1969b). Минералы, главным образом в виде фосфата кальция (CaP) или кристаллов гидроксиапатита (HA), могут быть соединены с коллагеновыми волокнами, обеспечивая кость определенной плотностью во время последовательной поэтапной минерализации костного матрикса.
Метаболиты, заключенные внутри костной ткани, не способны диффундировать сквозь костный матрикс. Обмен между остеоцитами и микроциркуляторным руслом происходит через очень тонкие цилиндрические пространства канальцев и цитоплазматические выросты, соединяющие «замурованные» остеоциты внутри минерализованных тканей с более поверхностно лежащими клетками нерушимым образом. Все кости выстланы с внутренней стороны эндостом, окружающим костный мозг, и надкостницей, покрывающей кость снаружи.
Основы анатомии костной ткани
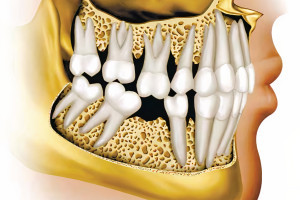
Макроскопически костная ткань классифицируется на компактную (кортикальную), которая составляет 80% от общего объема костной массы, и более глубоко расположенную с многочисленными переходящими друг в друга полостями так называемую губчатую или трабекулярную кость, которая составляет оставшиеся 20%. Кортикальная кость состоит из концентрически расположенных слоев матрикса, окружающего продольно проходящие сосуды в составе Гаверсовых систем, с преимущественно неремоделированной интерстициальной костной тканью, которая расположена между остеонами, обеспечивая костный каркас, который более слабый, нежели кортикальная кость, но обеспечивает метаболическую поддержку. Компактная костная ткань формируется цилиндрическими структурами остеонов, которые расположены концентрическими слоями, окружающими центральный или Гаверсов канал, являющийся источником необходимых для существования веществ, нервных волокон и кровоснабжения. На поверхности остеона формируется граница посредством цементирующей линии, возникшей в результате процесса ремоделирования костной ткани или формирования кости “de novo” согласно концепции заживления переломов (Davies 2003).
Согласно гистологическому подходу, костную ткань можно разделить в зависимости от расположения в пространстве коллагеновых волокон. При микроскопическом исследовании были обнаружены два различных вида костной ткани: ретикулофиброзная кость («плетеная кость») и пластинчатая кость (Currey 1969a). У грубоволокнистой костной ткани матрикс слабо минерализован, он формируется достаточно быстро в ответ на повреждение или адаптацию к чрезмерной нагрузке. Зрелая или пластинчатая кость формируется более медленно, а более структурированный костный матрикс делает ее более прочной; степень минерализации также влияет на стойкость и прочность кости (Traini с колл. 2006).
Существуют доказательства, что вариации в ориентации волокон коллагена внутри костного матрикса также связаны с механической нагрузкой и образом жизни (Riggs с колл. 1993; Traini с колл. 2005b). В предыдущих статьях было отмечено, что силы, возникающие при откусывании и жевании, оказывают значительный эффект на изменение селективного выравнивания с-осей в кристаллах аппатитов, что было продемонстрировано у обезьян (Nakano с колл. 2002). Данное наблюдение может быть частично объяснено, поскольку у костной ткани имеется специфичная анизотропная морфология, возникающая из-за однонаправленности коллагеновых волокон, что влияет на ориентацию кристаллов апатита, как и на индекс качества костной ткани, а также из-за ориентации остеобластов, которая, вероятно, определяет анизотропию кристаллов аппатитов при формировании нового матрикса (Matsugaki с колл. 2015). Анизотропия присуща тканям, у которых возникают различные механические характеристики при различных условиях деформации этих тканей (различный вектор приложения сил).